类器官冻存综述
类器官(Organoids)是在体外利用干细胞或组织原代细胞三维培养形成的微型器官模型,由于其具有自组织能力,可自发形成源器官的空间结构;功能模拟性,保留靶器官的生理/病理特性,同时具有遗传稳定性,长期培养仍维持基因组完整性,为生物医学领域(包括药物研发、肿瘤生物学、再生与精准医学以及组织器官移植)提供了不可或缺的研究平台。
2013年《Science》将类器官技术评为年度十大科学突破,标志着其成为生命科学研究的革命性工具。2014年后,随着类器官领域的快速发展,围绕类器官发表的文献快速增多。
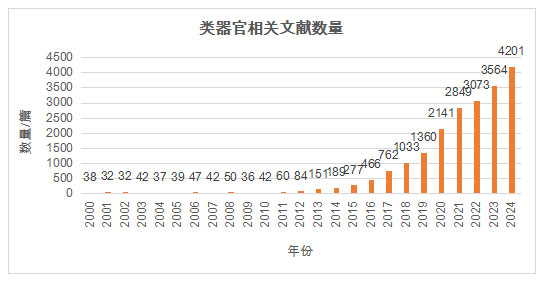
图1. 通过Pubmed检索“organoid”得到。2025年截至6月9日的文献数量为2226篇,预计年底会超过4500篇。
然而,类器官保存技术的不足限制了类器官在科研与临床中的广泛应用。目前大部分类器官研究借用普通哺乳动物细胞冻存的策略,采用普通的冻存液+慢速程序降温的方式对类器官进行冻存,部分研究团队也开始对冻存液进行优化,有些实验室由于类器官的特殊性,开始采取玻璃化冻存(超快速冻存)进行类器官的保存。通过优化预处理策略(如在培养基或冻存液中添加Rho激酶/肌球蛋白抑制剂)可提升冻存后复杂类器官结构的存活率。但类器官结构的复杂性及细胞组成的异质性带来了多重挑战,包括冷冻保护剂渗透不均、细胞间冷冻敏感性差异及冷冻损伤等问题。此外,现有质量评估体系缺乏能在短期内(无需长期再培养)判定类器官功能恢复的标准化方法,这也制约了类器官冻存技术的可重复性。
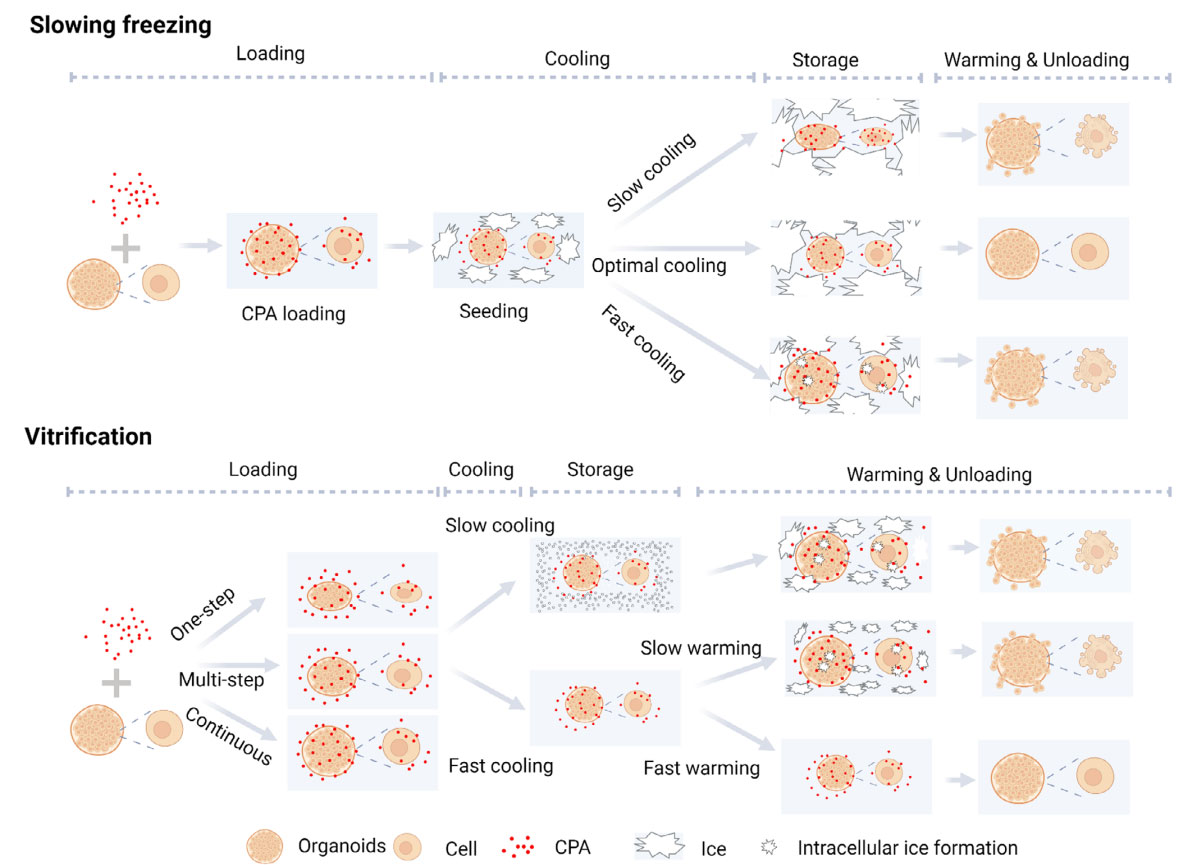
图1. 慢速降温和玻璃化冻存,Biotechnol. J. 2024
类器官的低温保存技术
低温保存的必要性
类器官在科研、药物筛选、再生医学及器官移植领域的需求日益增多,高质量、稳定的类器官供应迫在眉睫。合适的冷冻保存技术是为学术研究、临床和商业需求提供具有类器官的基础。从实验的简便性和成本角度考虑,直接获取即用型类器官也比繁琐的类器官生成过程更有价值。类器官生物样本库的建立为基础科学、工业和临床应用提供了宝贵资源,可减少多步骤类器官生成流程带来的问题,提高实验的可重复性。全球已建立超过15个规模较小的肿瘤类器官样本库,正常类器官的样本库鲜有报道。
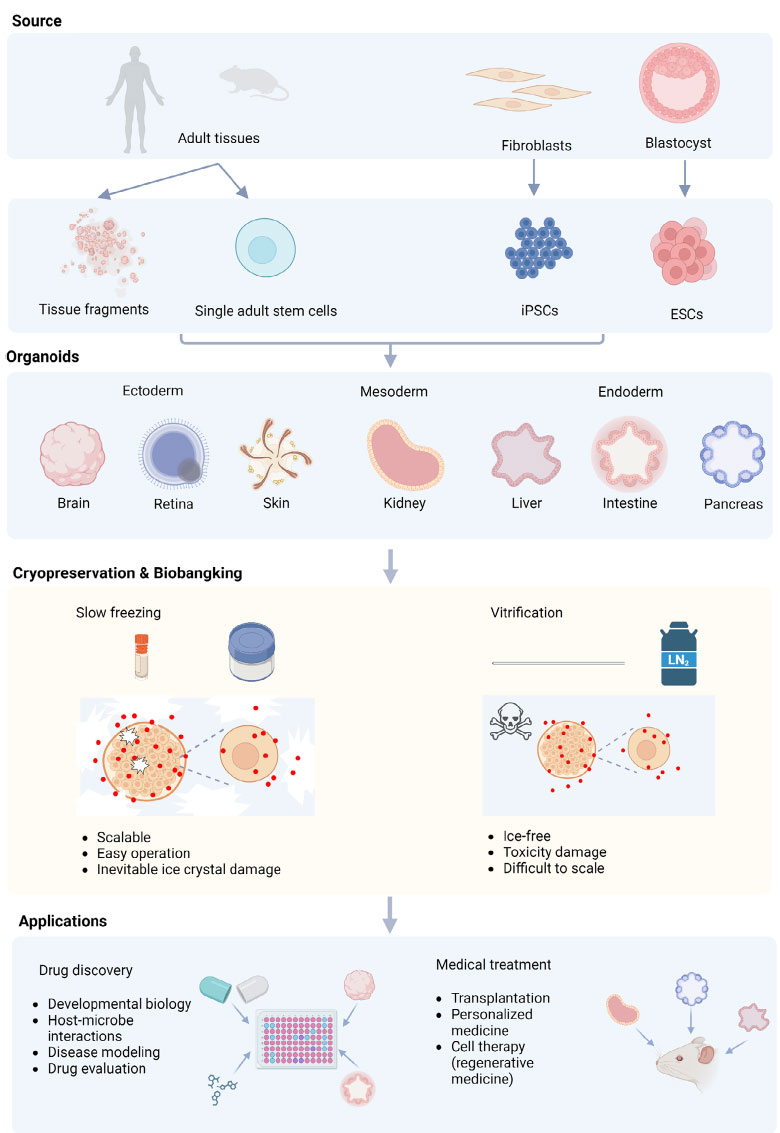
类器官制备、建库和应用流程,Biotechnol. J. 2024
三维结构冷冻的挑战
与以往冻存细胞不同,类器官是三维结构而非单细胞,整体体积较大,多种细胞和间质整合在一起,形成复杂结构,使冷冻方法更为复杂。多细胞结构冷冻保存面临的主要挑战包括:
· 多层细胞形成的有序结构,冻存液不易进入类器官内部,冻存液无法有效交换细胞内液体,更容易形成冰晶,冰晶生长导致细胞损伤;
· 冷冻过程导致有序细胞间相互作用可能被破坏
· 同一个类器官中不同细胞类型对渗透压和冷冻保护剂(CPA)耐受性的差异
图2. Nature Materials,2022
组织冷冻后类器官生成
过去十年中,许多研究尝试冷冻保存分离的组织片段复苏后再次培养形成类器官,到目前为止,肿瘤组织和正常组织都已成功实现冷冻后类器官的制备和传代。大多数冷冻方案使用含二甲亚砜(DMSO)的基础培养基。2024年Mashouf等发现采用含有10% DMSO的无血清冻存液进行肾脏类器官的冻存,冻存效果好于10% DMSO的含血清冻存液。对于临床转换的应用来说,无血清冻存液势在必行。使用符合GMP标准的无血清培养基、控制DMSO的浓度、采用商品化的冻存液是目前有临床转化需求的类器官冻存研究的方向。
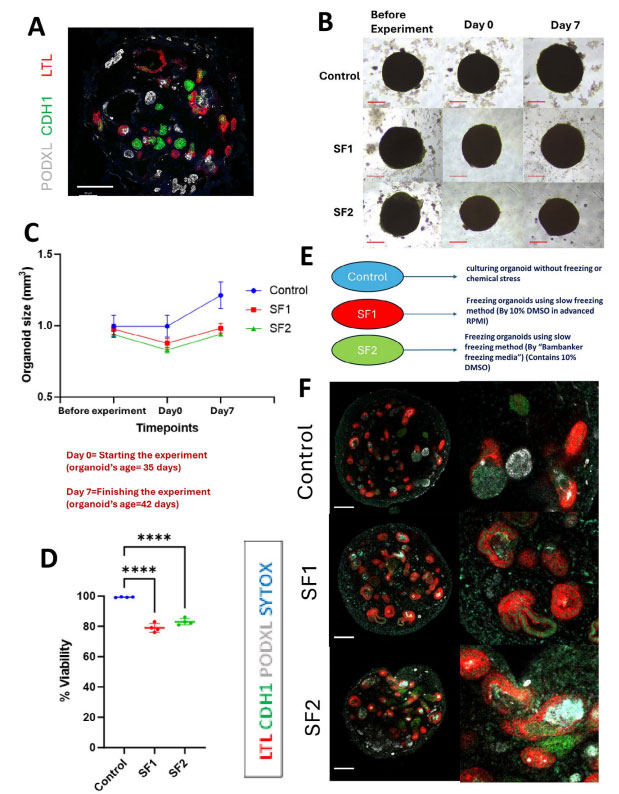
图3. 慢速程序降温条件下,无血清冻存液(SF2)效果好于实验室自配的含血清的冻存液(含10% DMSO的RPMI),Cellular and Molecular Life Sciences,2024
虽然冷冻组织产生的类器官数量可能略少于新鲜组织,但总体成功率相当。解冻后需要3-7天的恢复期来克服冷冻导致的暂时性功能活动减缓。值得注意的是,长期液氮储存可能导致存活率随时间下降,这也是在制定标准化冷冻方案时需要考量的一个点。
慢速(程序降温)冷冻方案
目前类器官的主流方案采用含7.5-10% DMSO,逐步降温(程序降温)至-80°C后转移至-150°C或-196°C。DMSO的最适浓度在不同类型的类器官冻存中存在很大差异。DMSO的浓度提高有助于在三维结构复杂的类器官中提高类器官内部细胞的通透性和冻存液与细胞内液体的交换效率,但过高的DMSO浓度对细胞本身也会造成损伤。为提高DMSO渗透性,较大结构通常在冷冻前处理成小于0.5mm直径的小块。验证类器官功能活性时,增殖潜力和基因特征的保持至关重要(翊尘生物的X-CTS™ FM100无血清冻存液适合类器官的冻存,目前可申请免费试用装,需要请咨询)。
目前大多数研究使用Rho激酶抑制剂Y-27632改善冷冻效果,该抑制剂可将类器官复苏率提高2.5倍。近期研究证实,肌球蛋白特异性抑制剂blebbistatin对视网膜类器官冷冻保存的益处。
由于类器官结构的异质性和复杂性,通常细胞程序降温采用的冻存速率(1-2℃/min)可能并不适合类器官的保存过程。程序降温仪可根据类器官的类型、组织块的尺寸、冻存体积的大小、冻存液成分的不同,灵活变更冻存程序,对于类器官的最佳降温程序的摸索提供了可能性。
玻璃化冷冻技术
玻璃化冷冻是一种通过超快速降温(>20,000°C/min)使生物样本直接转化为非晶态玻璃体的冷冻技术,在此过程中CPA在瞬间玻璃化转变中形成高黏度固态,可完全避免冰晶损伤。玻璃化冷冻通常用于卵母细胞、胚胎、分离的组织片段甚至整个器官等大尺寸样本的保存,相比传统的慢速冷冻,细胞存活率提升30-50%。该技术能冷冻具有显著不同生物物理特性的细胞,这对结构复杂的成熟类器官似乎更为适合。
与传统慢速冷冻技术不同,玻璃化冷冻通过采用快速降温速率和高浓度CPA(如20%的DMSO+20%的乙二醇),可有效防止细胞外介质结晶。高浓度的CPA能快速渗透并饱和类器官中心区域,因此比慢速冷冻更适用于多细胞结构的保存。目前,肿瘤类器官和干细胞来源的类器官的玻璃化冷冻已成功通过玻璃化冷冻实现更好的冻存效果。2024年Mashouf等通过玻璃化冷冻肾脏类器官,保留大量完整的LTL+近端小管和CDH1+远端小管,并成功存留PODXL+的最敏感的簇状足细胞结构;复苏后细胞活性与生长能力接近未冷冻样本;用顺铂毒性测试验证损伤后再生能力,Ki-67信号证实再生能力接近对照组。
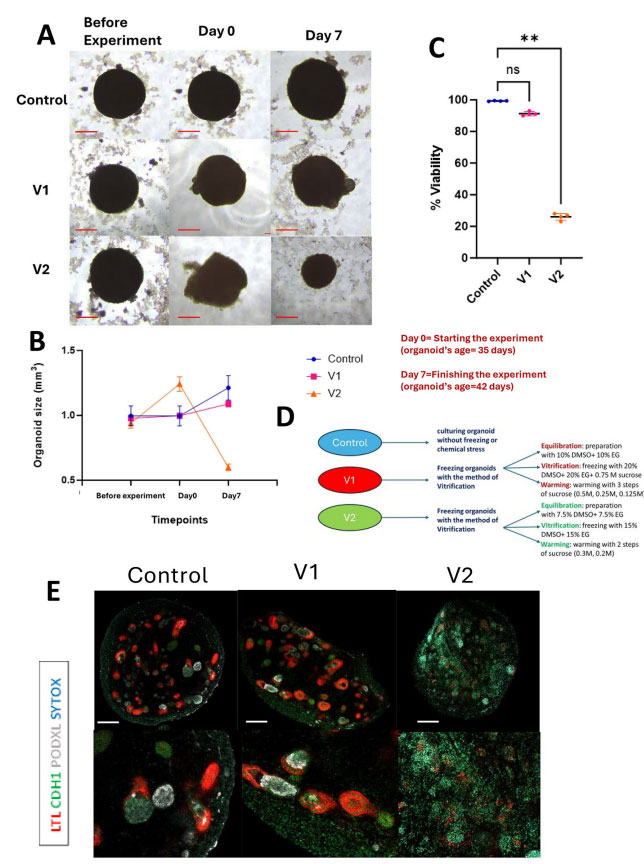
图4. 玻璃化冻存类器官在冻存前后的大小、活性、蛋白表达的变化,
Cellular and Molecular Life Sciences,2024
组别 | 近端小管(LTL) | 远端小管(CDH1) | 足细胞(PODXL) | DNA损伤(γH2AX) | 增殖标记 (Ki-67) |
对照组 | 完整 | 完整 | 簇状存在 | 微量 | 高表达 |
V1 | 轻微扩张 | 完整 | 保留80%* | 中度增加* | 显著表达 |
SF1/SF2 | 显著扩张* | 数量减少* | 完全缺失* | 高度累积* | 仅近端小管表达 |
V2 | 无法存活 | - | - | - | - |
图5. 玻璃化冻存肾脏类器官效果明显好于慢速程序降温冻存,根据文章内容整理,Cellular and Molecular Life Sciences,2024
不同研究中玻璃化冷冻液的成分存在差异,最常见的CPA包括DMSO、乙二醇以及糖类(蔗糖、棉子糖、右旋糖酐)。值得注意的是,玻璃化冷冻中常用的高浓度CPA在解冻后需立即通过梯度稀释法小心去除。冲洗冷冻保护剂时应采用渐进方式,以避免因渗透压差异导致的细胞肿胀。
CPA去除的最终步骤通常涉及离心操作,这会增加类器官结构受损风险,并作为额外应激因素加剧细胞损伤。寻找更好的洗涤方案也是提升玻璃化冻存效果需要解决的问题之一。
随着对冷冻过程中细胞关键参数认识的深入,定量建模方法有望揭示冷冻保存中的复杂物理动力学。通过模拟,可确定CPA平衡饱和的最短时间,并根据细胞膜通透性和三维结构的个体差异优化降温程序。未来需开发标准化冻存方案,并建立功能评估体系,最终实现类器官库的临床与产业化应用。











