CAR-MSC——提升免疫抑制功能新策略
艾米迈托赛注射液开出首张处方
2025年6月5日,由铂生生物开发、国内首款MSC细胞药物艾米迈托赛注射液,在北京大学人民医院由黄晓军院士团队首张处方开出,输注者为年轻女性患者,合并重度肠道急性移植物抗宿主病,前期接受了其它治疗方案,未获得理想效果。该处方的开具标志着我国干细胞药品正式开启商业化临床应用。
移植物抗宿主病(GvHD)是由于移植后异体供者移植物中的T淋巴细胞,经受者发动的一系列“细胞因子风暴”刺激,大大增强了其对受者抗原的免疫反应,以受者靶细胞为目标发动细胞毒攻击,其中皮肤、肝及肠道是主要的靶目标。 急性移植物抗宿主病发生率为35%~64%。
作为二线疗法,MSC药物对常规激素治疗无效的aGvHD患者展现出显著疗效,尤其是在重症(III-IV级)病例中。然而,由于MSC自身异质性、扩增/鉴定方案差异或靶向性不足等因素,针对其它情况的GvHD或其它类型的疾病效果仍然有限。目前已有研究尝试通过细胞因子预处理、细胞外泌体调控和基因修饰等手段提升疗效,但这些方法仍存在免疫抑制不足和靶组织特异性缺失等问题。
在此小翊推荐一篇来自Nature Biomed England的文章,通过嵌合抗原受体(CAR)改造MSC,该受体包含可结合抗原靶标的外周单链可变区片段(scFv),以及能在抗原刺激下介导下游激活信号的胞内结构域。通过CAR的加持,MSC针对抗原特异性炎症靶点的免疫抑制能力显著增强,同时提升了MSC的组织靶向性,动物实验提示CAR-MSC长期的安全性。该方案为未来的细胞药物设计提供了新的思路。

l CAR的设计和对MSC基因表达影响
GvHD的发病机制涉及供体T细胞通过整合素与胃肠道表达的E-钙黏蛋白(Ecad)相互作用,进而攻击宿主上皮组织。作者认为靶向Ecad的CAR-MSCs(EcCAR-MSCs)可通过增强在GvHD及其它免疫介导性疾病炎症部位的免疫抑制功能来保护宿主组织。为实现MSCs向Ecad+易受免疫攻击组织的定向迁移,作者通过噬菌体展示技术筛选出多个抗Ecad单链可变区片段(scFv)克隆用于CAR构建。最终选定的优化scFv序列具有人源、鼠源和犬源的交叉反应性,可在动物模型中开展临床前试验。这里作者选择D28ζ作为共刺激结构域,因其具有双重功能:一方面可通过诱导下游免疫调节因子维持免疫稳态;另一方面在效应T细胞和免疫抑制性调节T细胞(Treg细胞)的工程化(CAR-T、CAR-Treg)已有明确功能验证。CD28的免疫调节作用具有细胞类型和微环境依赖性,既能促炎也能抗炎。这一设计的有效性在后续的实验结果中也得到了验证。
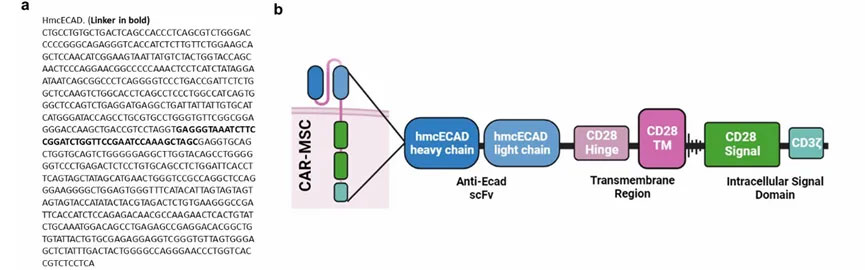
CAR的骨架设计及序列
改造的EcCAR-MSC仍保持了良好的MSC形态学特征和表型。细胞标记物增强的基因集富集分析表面CAR转导后,脂肪源性干细胞表型相关基因在EcCAR-MSCs上调基因中显著富集,而分化细胞谱系相关基因则在下调基因中富集,提示CAR的转导未明显影响到MSC的干性特征。
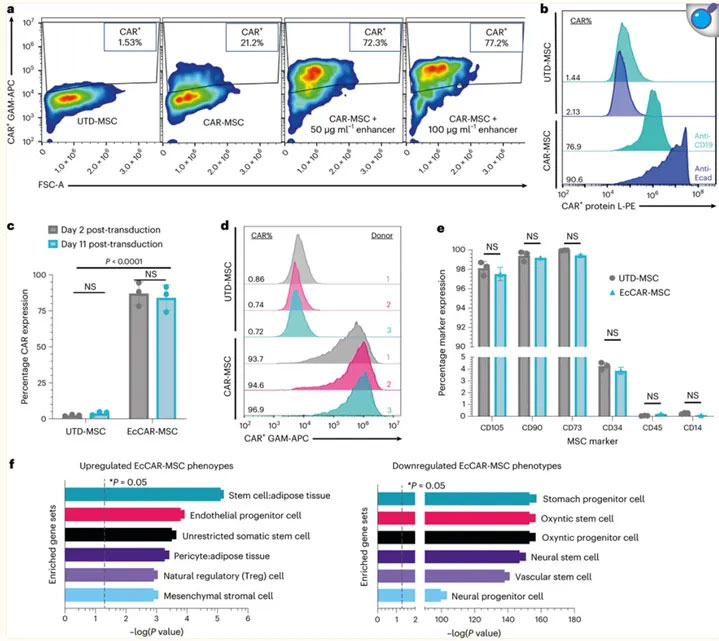
CAR对MSC的转导效率、特征标记物的表达,以及基因谱系表达变化
l EcCAR-MSC在体外的免疫抑制功能
作者通过T细胞抑制效应实验验证EcCAR-MSC的免疫抑制功能。CAR的活化通过E-Cad完成。通过可溶性E-Cad的刺激,EcCAR-MSC对T细胞呈现出剂量依赖性的抑制作用,这种作用明显强于普通未转导的MSC对照 ,其表型在刺激后仍然维持干细胞特征。另外,用稳定表达E-Cad的细胞株作为抑制效应实验的刺激物,也显示出抗原依赖性的T细胞抑制效应,同时,CD28ζ活化的主要信号分子磷酸酯酶C-γ (PLCγ)的磷酸化水平明显上调,进一步支持抗原特异性的EcCAR-MSC活化及免疫抑制功能。
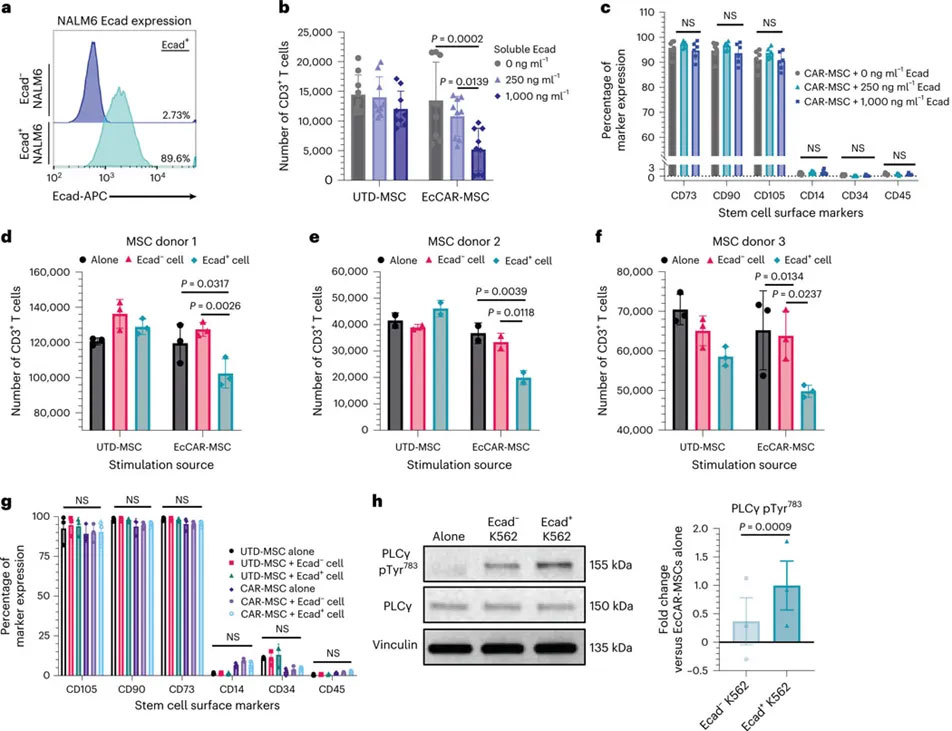
可溶性E-Cad蛋白和稳定表达E-Cad的K562细胞都能明显活化EcCAR-MSC的体外免疫抑制功能
l EcCAR-MSC在小鼠肿瘤模型和小鼠GvHD模型中的抑制作用
作者又进一步通过体内实验验证了EcCAR-MSC的抑制作用。他们采用了之前验证有效的小鼠移植物肿瘤模型:E-Cad表达阳性的急性淋巴细胞白血病细胞系NALM6细胞接种进NOD-SCID-γ−/−(NSG)小鼠获得。该模型的肿瘤可通过CART19有效清除。此模型中,Ecad+ NALM6细胞可直接为CAR-MSC提供抗原特异性刺激,便于后续CAR-MSC的活化。治疗结果显示,在Ecad+ NALM6异种移植模型中,与对照组相比,EcCAR-MSC治疗显著抑制了CART19的抗肿瘤活性。值得注意的是,在NALM6共培养实验中,EcCAR-MSC本身并不会直接促进白血病细胞生长(数据未在此列出)。
采用另一种EcCAR-MSC的活化方式:联合注射经辐照的Ecad+ MCF7细胞也发现了类似的情况, EcCAR-MSC的治疗仍然可以显著削弱抗肿瘤活性并降低异种移植模型生存率(数据为在此列出)。以上结果充分证明,在体内存在Ecad抗原的情况下,EcCAR-MSC具有强大的免疫抑制潜能。
GvHD异种移植模型通过静脉注射人外周血单个核细胞(PBMC)至NSG小鼠体内构建。小鼠模型发生GvHD后通常会经历体重下降、毛发、皮肤完整性变差、活动水平下降、生存期缩短等问题。与PBS、UTD-MSC对照组相比,EcCAR-MSC输注能显著改善体重下降、改善临床症状(包括毛发状态、皮肤完整性、体态和活动度)并提高总体生存率。
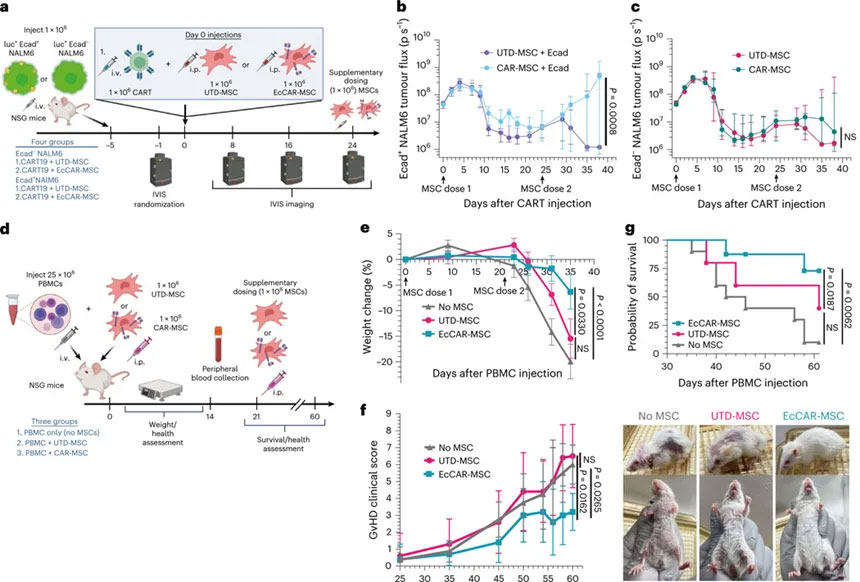
EcCAR-MSC体内免疫抑制功能和治疗效果:对CART19和GvHD的治疗效果及临床症状改善
l EcCAR-MSC的靶向迁移能力
细胞药物的组织靶向性非常重要,靶向性差既可能引起靶向组织药物浓度低导致的治疗效果下降,也会造成非靶向组织的毒副作用。作者在此重点分析了EcCAR-MSC在GvHD模型结肠Ecad+上皮组织的抗原特异性激活与迁移特性。实验过程构建了GFP+荧光素酶+ EcCAR-MSC和GFP+荧光素酶+CD19-CAR-MSC,在GvHD模型中评估其迁移能力与治疗效果。实验中为了诱导更为严重的急性GvHD表型,还在PBMC和MSC注射前对小鼠进行了辐照,输注后1周内即出现急性GvHD症状。
在此急性GvHD模型中,EcCAR-MSC能显著减轻体重下降并延长生存期。治疗1周后处死实验卫星组小鼠,通过BLI和免疫荧光检测器官中CAR-MSC分布。值得注意的是,结肠组织检测显示EcCAR-MSC在Ecad+结肠组织的浸润能力显著优于CD19-CAR-MSC。这些结果共同表明,EcCAR-MSC在GvHD模型中具有更强的免疫抑制效果和组织靶向性。
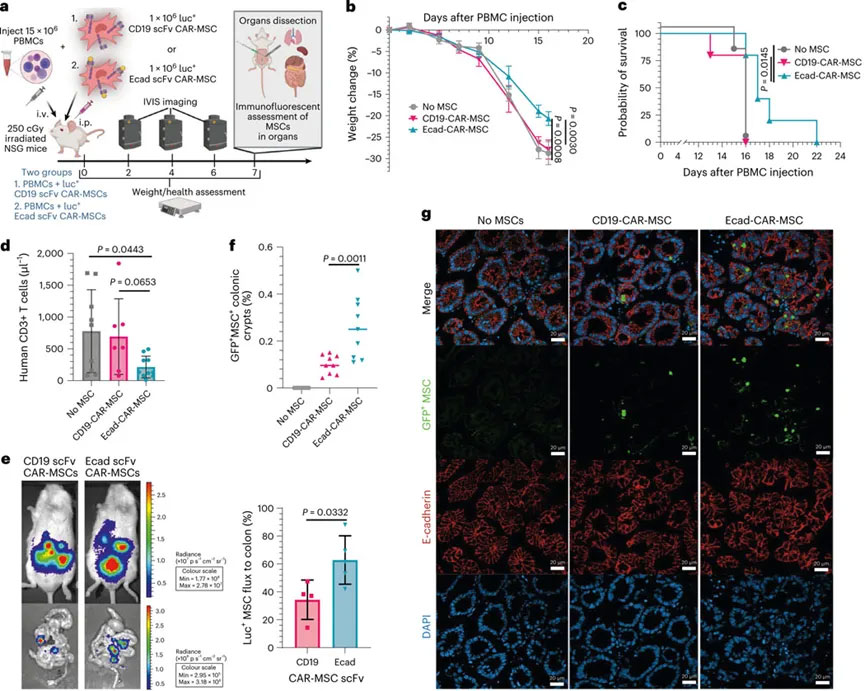
经EcCAR-MSC治疗后,GvHD模型小鼠的体重和生存期变化、EcCAR-MSC的组织分布情况
后续作者还针对CAR-MSC的作用机制、CD28ζ和CD3信号结构域的必要性以及CAR-MSC的安全性做了评估,进一步支持了CAR-MSC临床应用潜力。在此就不展开讨论。有兴趣的伙伴建议阅读原文。
综上,CAR-MSC可显著提升MSC的免疫抑制功能和组织靶向性,最终显著提升GvHD的治疗效果,CAR-MSC有望成为移植物抗宿主病及其它多种免疫相关疾病的新型治疗选择。然而,该结果仍然处于动物实验阶段,应用前景仍需通过临床试验进一步验证。











