外泌体与ED
随着年龄增长,ED会逐渐变为高发,40岁男性发生比例大约为40%。出现ED不仅影响到患者的性生活,还可能提示潜在的心血管或糖尿病等疾病的发生,有人甚至把是否ED当成“男性身体健康的晴雨表,男性精神健康的指示器”。外泌体又是如何改善ED的呢?
1. 啥是ED?
是一种常见男性疾病,指男性无能力达到性生活所需要的充分勃起或维持勃起时间过短的病症。ED的文献最早见于5000多年前古埃及,1993年,NIH才正式明确ED的定义。
ED是严重影响男性健康的普遍医学问题,随着现代社会生活节奏的加快,年龄的增长,生活水平的提高,心血管、糖尿病等疾病的发生率提升,男性ED的数量和比例都在提升。预计2025年全球ED病例会超过3.22亿,排除25%的未成年,成年男性患ED的比例可能≥10%,这是个惊人的数字。
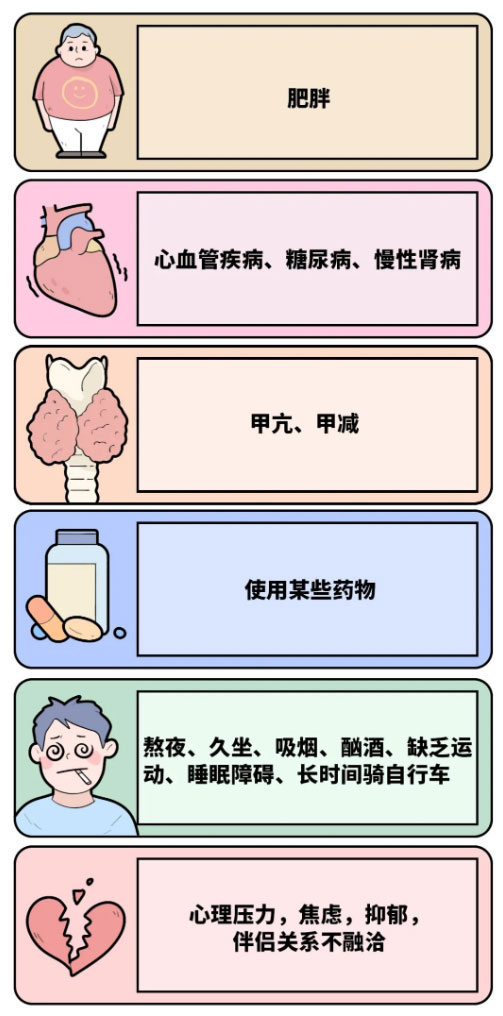
2. ED的成因?
过去普遍认为精神疾病是ED的主要诱因,但大量研究表明,80%以上的ED病例由器质性病因导致。心血管疾病、糖尿病、血脂异常、性腺功能减退及神经损伤均为ED的独立危险因素。更重要的是,ED不仅与性功能障碍相关,还可能提示潜在的血管内皮功能障碍,成为心血管疾病的早期预警信号。
基于一氧化氮(NO)在海绵体平滑肌松弛中的作用,选择性5型磷酸二酯酶抑制剂(PDE5i,如西地那非)作为ED一线治疗药物,可使63%的患者勃起功能改善。但治疗效果仅限于缓解症状,往往是出现暂时性的好转而非永久性治愈或根本的病理性改善。对于严重 ED 的治疗突破则更加有限,其中,糖尿病性 ED 以及创伤后 ED(包括医源性)更加严重,且对传统药物治疗反应不佳。
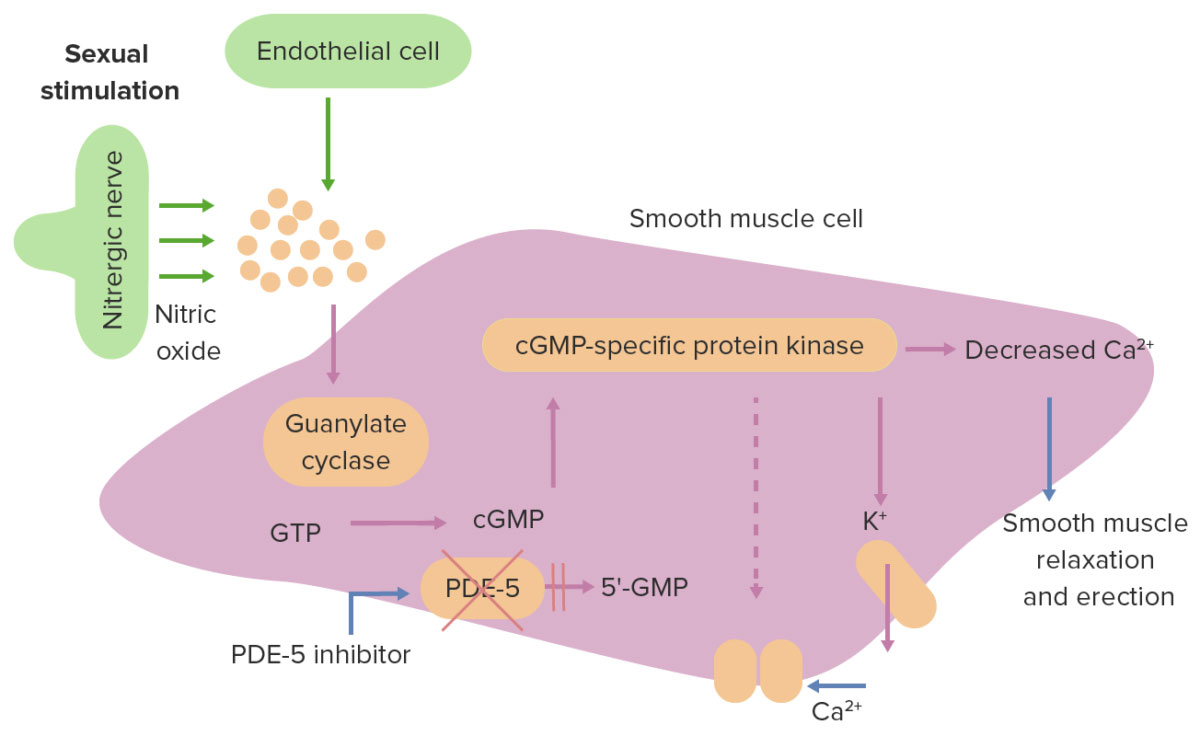
ED发生和PDE-5i治疗的分子机理
3. 什么是外泌体?
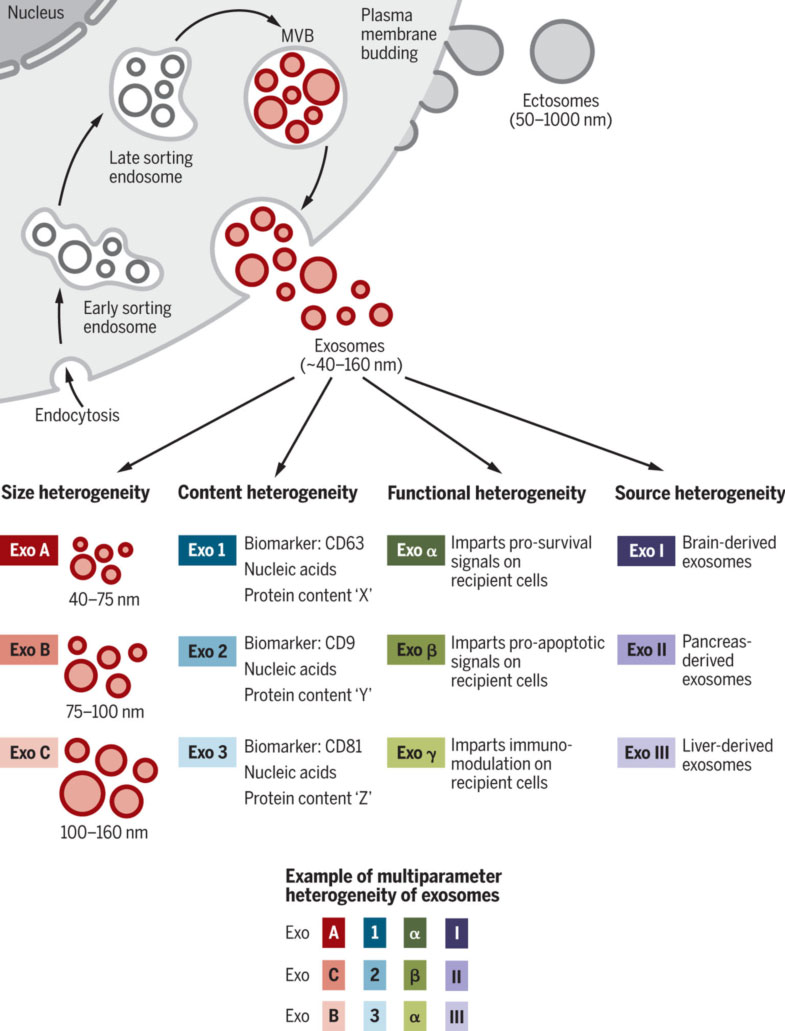
小翊在之前的文章里介绍过外泌体。A外泌体是直径约40-160 nm的纳米颗粒,由多种细胞在生理或病理条件下分泌。其双层膜结构通过包裹胞外成分、膜蛋白及与其他囊泡、细胞器相互作用形成,因此含有代谢物、蛋白质、脂质和核酸等多种成分。
外泌体具有高度异质性,其来源细胞、大小、组成及对受体细胞功能的影响差异显著。膜表面蛋白是外泌体检测的基础。
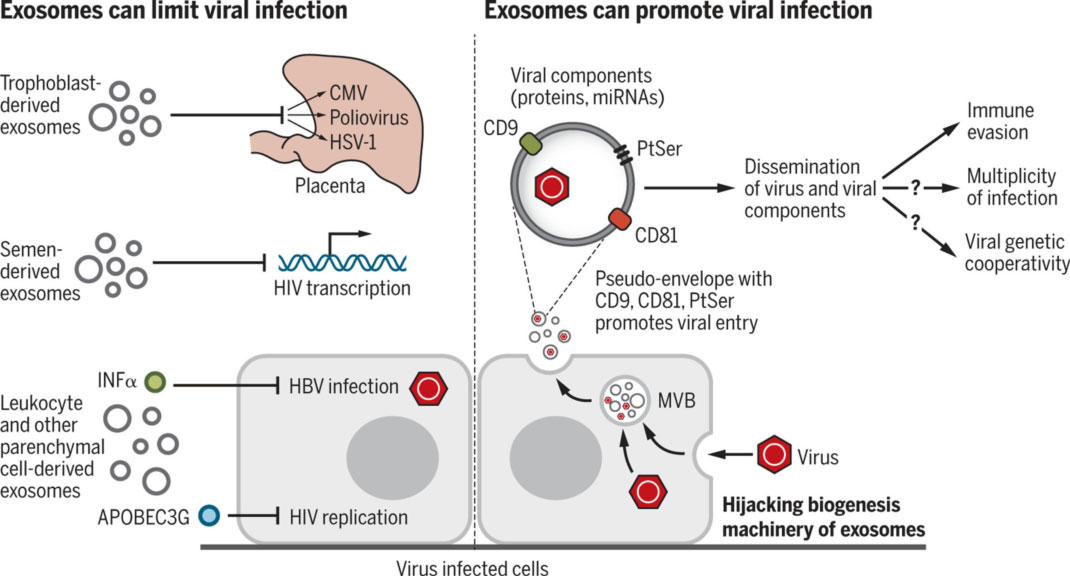
外泌体参与人体多种生理病理过程,可作为细胞间通讯的分子与信号载体。其生物发生机制使细胞能够快速选择性清除质膜蛋白,促进精卵结合等过程。外泌体还与病毒感染过程相关,并参与先天性和适应性免疫应答的诱导。研究表明,外泌体可能参与心血管代谢性疾病、神经系统疾病发病机制,并动态影响肿瘤进展。
外泌体在临床研究中备受关注。外泌体非编码RNA(ncRNA)在多数人类疾病中呈现差异表达,为疾病早期生物标志物的开发奠定基础。外泌体还可作为药物递送系统(DDS)用于癌症治疗。动物实验中,移植骨髓通过释放富含miR-106b-5p和miR-222-3p的外泌体促进受损β细胞再生。间充质干细胞来源的外泌体miRNA具有抗动脉粥样硬化特性。基于此,探索外泌体在糖尿病或心血管疾病引发的ED患者中的应用价值具有重要意义。
4. 外泌体对ED的潜在治疗价值?
目前外泌体的研究集中多集中在肿瘤治疗和美容抗衰领域,ED相关研究相对较少。外泌体改善ED的研究最早报道于2017年。而外泌体与勃起功能障碍(ED)的相关性研究较少。
关于外泌体改善ED作用的研究首次于2017年改善糖尿病引起的ED的报道(J Sex Med 2017)。ED被视为糖尿病的长期并发症之一,糖尿病患者发生ED的风险增加2.5倍,且超过50%的糖尿病患者受到ED影响。糖尿病患者主要表现为高血糖和胰岛素抵抗,通常伴随代谢综合征(肥胖、高血压、血脂异常)、性腺功能减退、心血管疾病及神经病变(69)。这些表现和共病症会影响雄激素水平、动脉血流输入、静脉血液回流以及神经信号传导,并最终影响勃起过程中活性氧、一氧化氮(NO)、环磷酸鸟苷(cGMP)和一氧化氮合酶(NOS)的产生,以及内皮细胞和海绵体平滑肌细胞(CCSMCs)的功能。
Chen等通过超速离心法从脂肪源性干细胞(ADSCs)中分离外泌体,并建立II型糖尿病大鼠模型。研究发现ADSCs来源的外泌体可通过以下机制促进勃起功能恢复:提高最大海绵体内压(ICP)与平均动脉压(MAP)比值、增加内皮组织与平滑肌含量、减少海绵体内皮细胞和平滑肌细胞凋亡。除2型糖尿病外,1型糖尿病同样会诱发ED。Zhu等(Andrologia. 2018)向I型糖尿病ED模型大鼠注射三种剂量(分别为0、10和100 mg)的ADSCs外泌体,证实外泌体以剂量依赖方式通过逆转纤维化、增加内皮含量及促进血管生成来改善勃起功能。值得注意的是,研究者对外泌体进行miRNA测序发现,这些外泌体含有促血管生成miRNA(如miR-126、miR-130a、miR-132)和抗纤维化miRNA(如miR-let7b和miR-let7c)。虽然这些miRNA在ED治疗中的作用尚未通过体外或体内实验验证,但该发现揭示了外泌体治疗ED的潜在机制,为后续研究开辟了新视角。
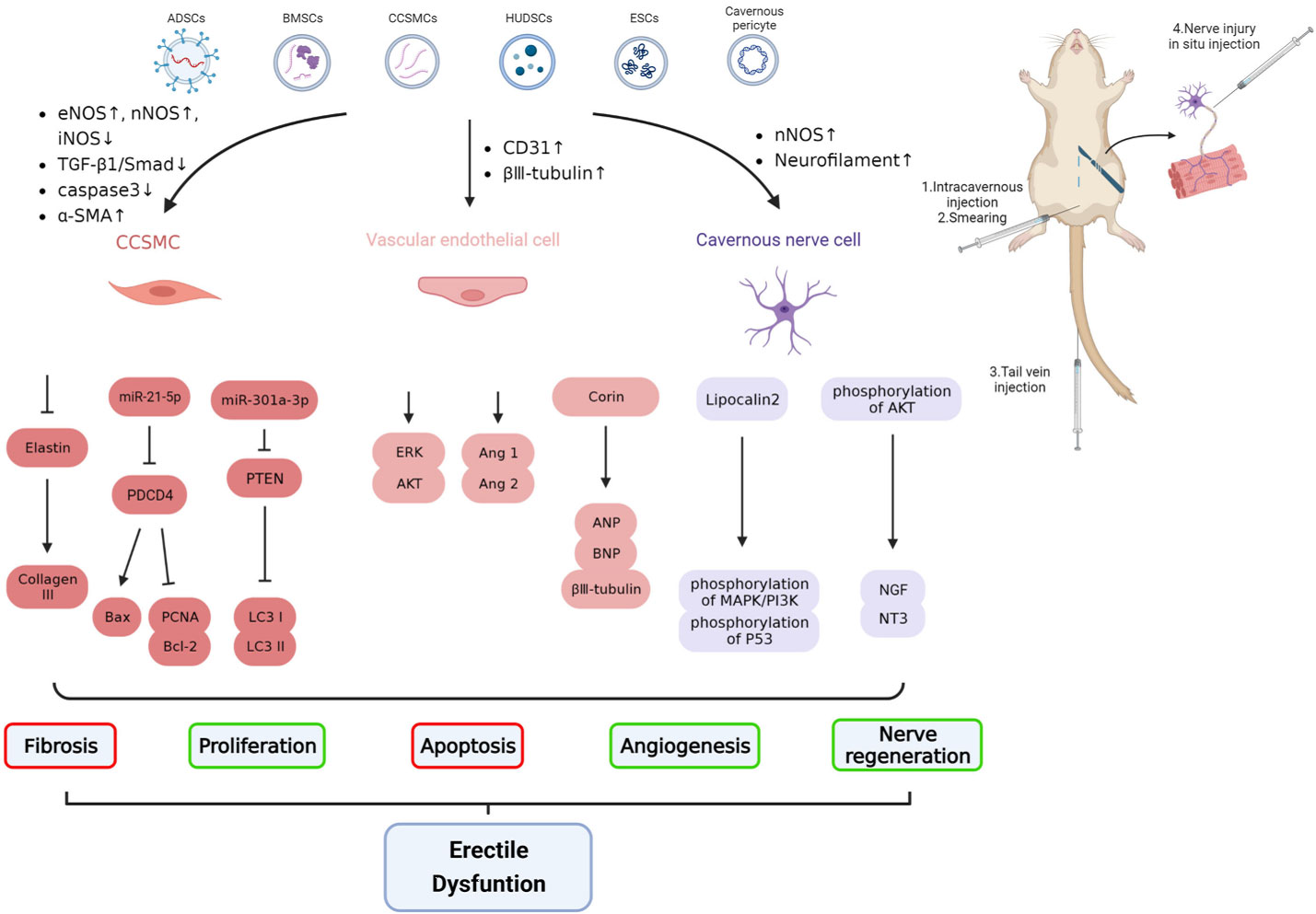
Front. Endocrinol. 2023
特别需要指出的是,通过转基因技术改造供体细胞可使其分泌的外泌体携带特定功能分子。例如:经miR-21-5p-agomir处理的骨髓源性干细胞(BMSCs)所产生的外泌体中miR-21-5p含量显著增加,该miRNA通过下调海绵体平滑肌细胞(CCSMCs)中靶基因PDCD4的表达,抑制细胞凋亡并促进增殖,从而改善勃起功能。另有研究表明,转染siRNA的ADSCs外泌体可促进神经血管功能,同时降低TNF-α、IL-1β和IL-6等炎症因子水平。
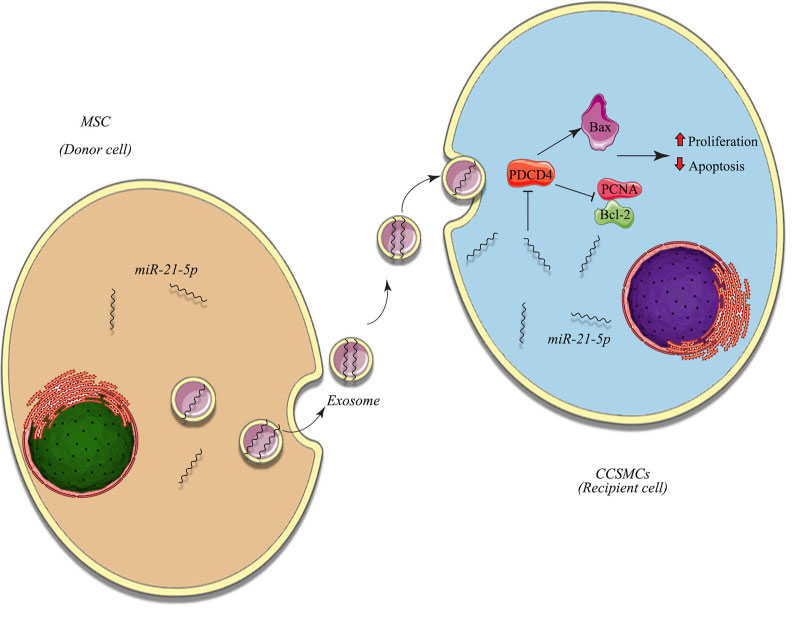
Stem Cell Res Ther. 2025
双侧海绵体神经损伤诱导的ED(BCNI-ED)
前列腺癌手术及其他盆腔手术常导致海绵体神经损伤,该神经起源于盆神经节(MPG),调控海绵体平滑肌细胞(CCSMCs)的收缩与舒张,从而影响勃起功能。海绵体神经损伤后,多种分子及信号通路(如TGF-β、硫化氢、NO通路、RhoA/ROCK通路及氧化应激相关通路)参与ED的发生发展。双侧海绵体神经损伤(BCNI)后,这些因子的失调会导致组织纤维化,以及CCSMCs的表型转化与凋亡。
ADSC和BMSC来源的外泌体不仅可用于糖尿病性ED,亦对BCNI-ED具有治疗潜力。欧阳等研究发现,向BCNI-ED大鼠海绵体内注射外泌体4周后,外泌体通过抑制CCSMCs凋亡显著改善勃起功能(Stem Cell Res Ther. 2018))。Li等也在BCNI-ED的大鼠模型中发现,ADSC和BMSC外泌体在BCNI大鼠模型中均能有效恢复勃起功能(Andrology. 2018),两者均可减轻神经解剖结构异常、平滑肌萎缩及胶原沉积,从而改善勃起障碍。
Feng等总结了大部分外泌体用于ED治疗的动物实验模型,如下表所示:
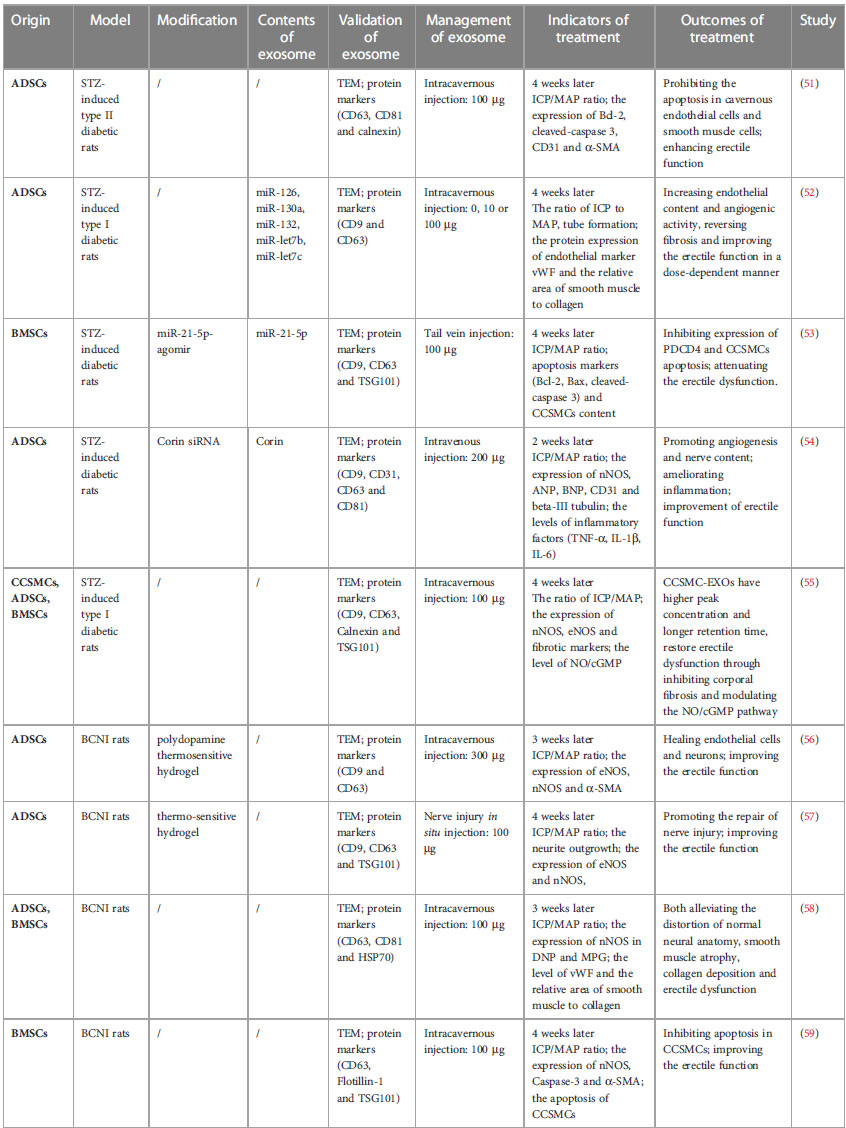
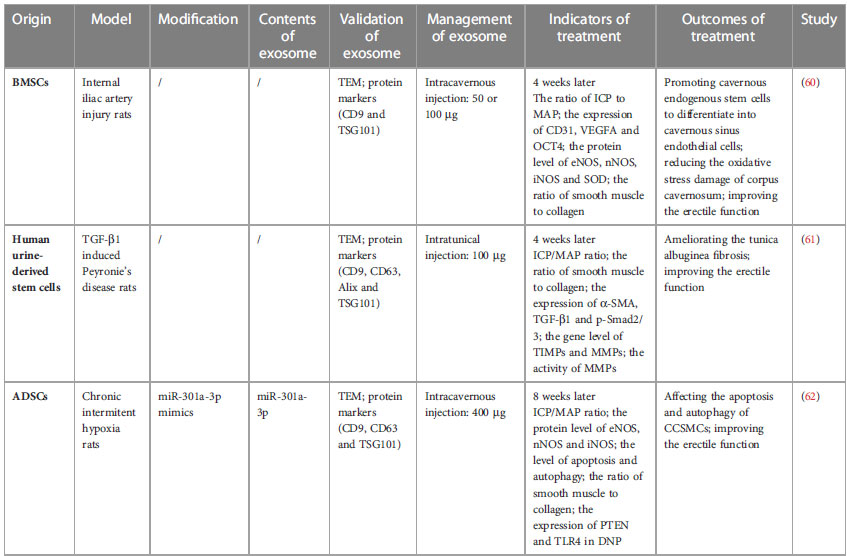
Front. Endocrinol. 2023
未来展望
现存研究主要聚焦外泌体对ED的治疗效应及机制,但对其内容物及其治疗效果的影响相对较少。未来需重点解析外泌体中关键活性分子(如特定miRNA或蛋白)在ED治疗中的作用机制。目前仍有若干关键问题待解决:长期安全性评估、最佳外泌体来源选择、治疗方案优化(包括剂量与疗程)、适宜递送系统开发以及具体作用机制的阐明。临床试验的安全和有效开展需要基于更多分子机制的揭示。
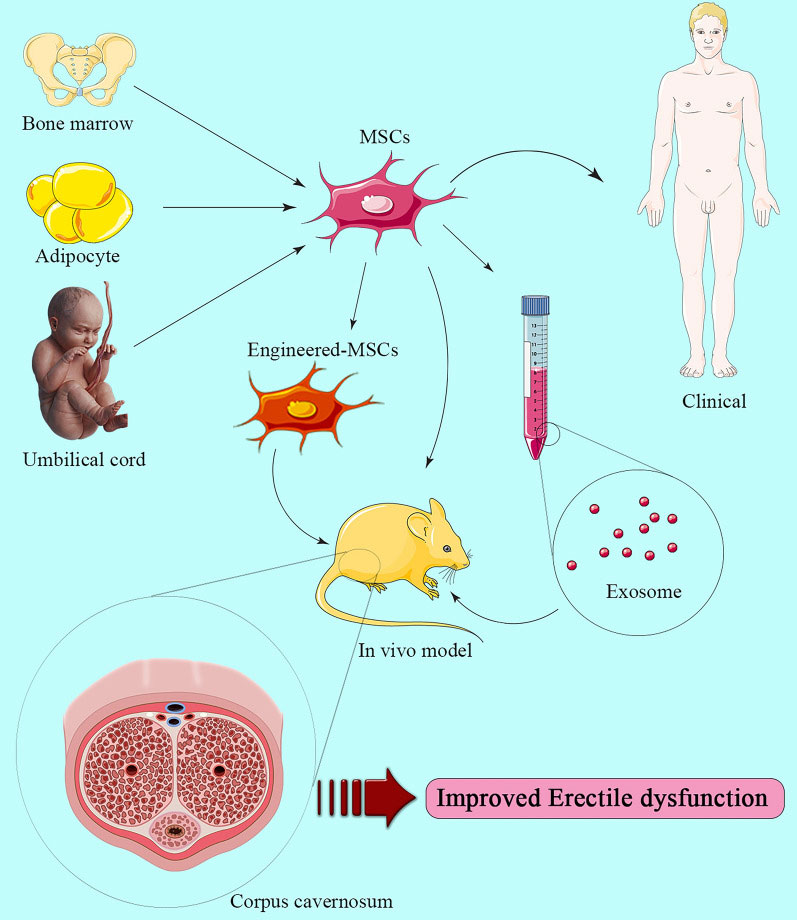
MSC和MSC来源外泌体对ED的治疗作用示意图
Stem Cell Res Ther. 2025











