靶向BCMA的体内CAR
靶向BCMA的体内CAR-T细胞疗法治疗复发/难治性多发性骨髓瘤
近期细胞基因治疗领域最热的研究方向莫过于体内CAR-T疗法。普通的CAR-T治疗由于制备流程复杂漫长、运输条件苛刻、成本高昂等原因,使得很多病人无法受益。在此情况下体内CAR-T应运而生。
体内CAR-T采用纳米抗体修饰的慢病毒/AAV载体,通过静脉注射直接靶向体内T细胞,递送CAR基因(如抗BCMA、CD19等),实现原位基因编辑,获得体内CAR-T细胞。体内CAR-T无需在体外对T细胞进行基因编辑,省去了采血、制备细胞、清淋等步骤,也简化了质量控制的步骤,整体成本大幅缩减,与普通体外CAR-T相比展现了更高的患者可及性和应用潜力。目前已有团队使用慢病毒载体实现体内CD19 CAR-T进行临床前研究,临床数据相对较少。
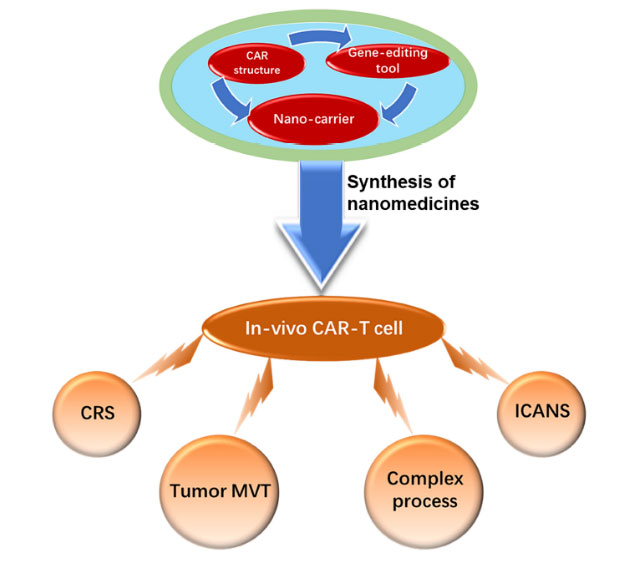
7月2号发表在柳叶刀杂志的通讯文章《In-vivo B-cell maturation antigen CAR T-cell therapy for relapsed or refractory multiple myeloma》,分享了携带人源化抗B细胞成熟抗原(BCMA)单域抗体CAR的临床数据,4例患者完成体内CAR-T治疗及2个月随访,显示出髓外病灶的清除潜力。

² CAR的设计
文章采用ESO-T01纳米抗体靶向、具有免疫屏蔽功能的慢病毒载体进行体内CAR-T改造。,ESO-T01携带人BCMA单域抗体CAR。ESO-T01的另一特点是水疱性口炎病毒糖蛋白G的关键残基的定点突变及过表达CD47,这样做的好处是抑制单核吞噬系统的吞噬作用,提高CAR对T细胞的靶向性。此外,MHC-I的基因敲除,可降低免疫原性。
² 入组患者情况
该研究报告了一项正在进行的单臂、开放标签、剂量递增的I期临床试验中,首批接受最低剂量ESO-T01治疗的4例成人(年龄≥18岁)复发/难治性多发性骨髓瘤患者的首次人体数据,所有患者均经确认存在BCMA表达,既往接受过至少二线治疗且出现疾病进展或对免疫调节剂和蛋白酶体抑制剂耐药,并具有可测量病灶。研究旨在评估其安全性、耐受性和初步疗效。
患者1为五药耐药且伴多发性髓外病变。患者2在出现两处骨旁肿块前曾接受串联自体造血干细胞移植。患者3对四种既往治疗方案耐药,表现为广泛髓外病变。患者4对BCMA-G蛋白偶联受体C组5成员D靶向的CAR-T细胞治疗无应答。
² CAR输注方式
所有患者均单次静脉输注2.0×10⁸转导单位的ESO-T01起始剂量,未进行预先单采血和淋巴细胞清除。预防性使用盐酸异丙嗪,并根据临床判断使用双氯芬酸栓剂预防输注后体温骤升(虽未在方案中明确规定)。基于患者1的输注后反应,患者2-4在输注前额外给予20mg地塞米松。
² 患者输注后反应及处置:
Ø 不良反应:
• 发热:所有患者在输注当天均出现急性炎症反应,表现为先寒战、3小时内发热并持续6-18小时(图A)。
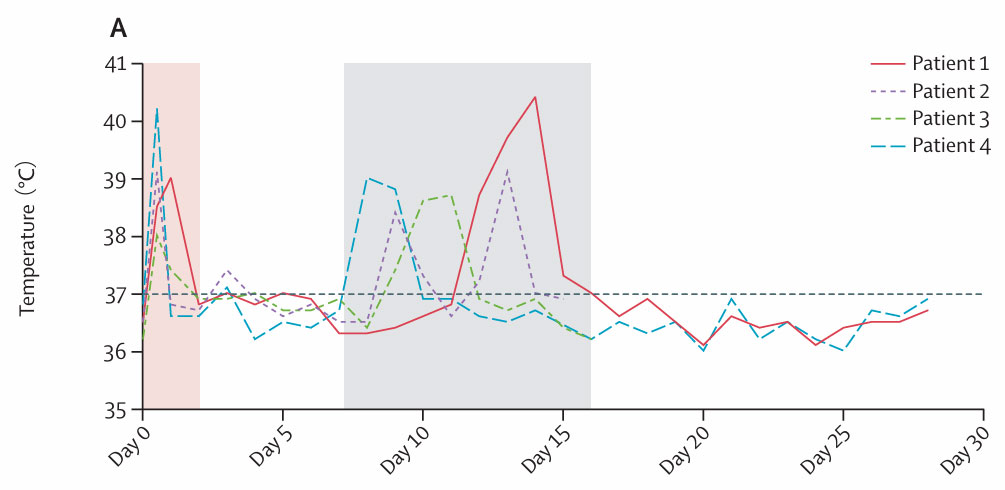
• 患者1、2、4出现低血压,患者1、4需吸氧治疗。患者1还出现轻度意识障碍和双上肢震颤,经地塞米松(10mg)和丙种球蛋白治疗后48小时内症状缓解。患者3主诉头痛和下肢肌肉酸痛,经对症治疗后缓解。实验室检查显示细胞因子、C反应蛋白、铁蛋白和肝酶一过性升高。
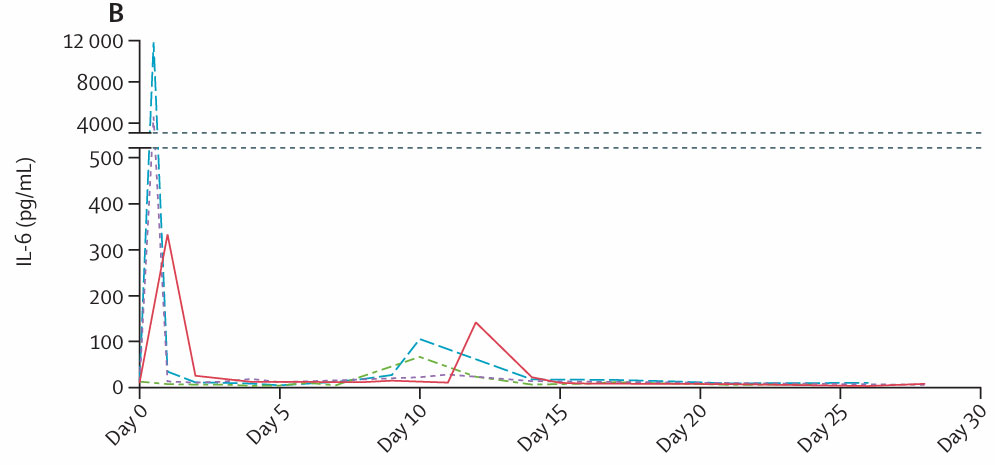
• 细胞因子释放综合征(CRS):所有患者均出现CRS,患者1、2、4为3级,患者3为1级。淋巴细胞计数在最初12小时急剧下降,48小时内逐渐恢复。第8-12天所有患者出现以发热为特征的1级CRS,持续1-4天,伴随IL-6和IL-10第二峰值。值得注意的是,脑脊液肿瘤负荷最高的患者4在第8天出现1级免疫效应细胞相关神经毒性综合征(ICANS),两者均经糖皮质激素控制。输注后出现3-4级血液学毒性,包括中性粒细胞减少(患者1、2、4)、白细胞减少(患者2、4)、血小板减少(患者3、4)和淋巴细胞减少(患者2、3、4),多数在随访期间恢复至基线。患者2、4在28天内出现肺部感染,经抗生素控制。
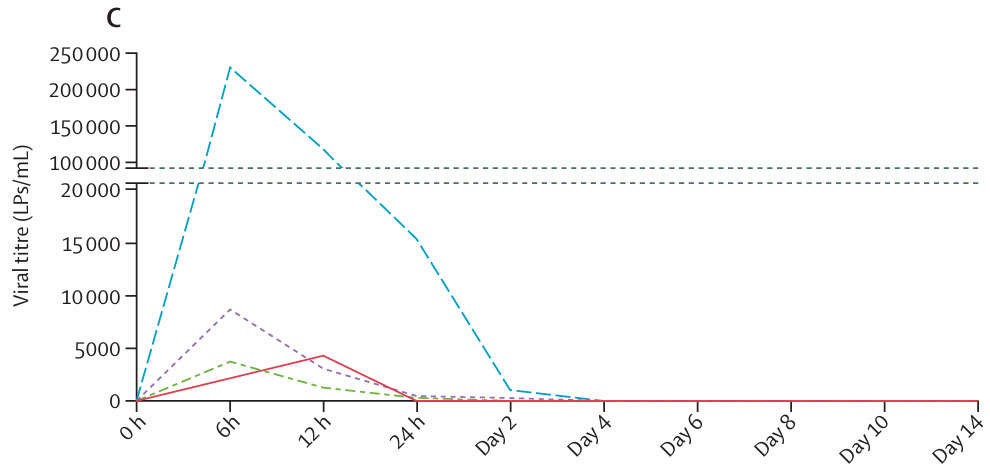
• CAR病毒载体分布情况:患者尿液、唾液和脑脊液中均未检出病毒,外周血病毒滴度在12小时内达峰,48小时基本消失(图C)。
Ø 治疗效果:
• 所有患者均完成2个月随访,其中前两例已完成3个月随访。患者1在第2个月时达到严格完全缓解(所有髓内及髓外病灶消失),患者2则在第28天实现严格的完全缓解。患者3和4达到部分缓解,肿瘤病灶缩小且第28天骨髓微小残留病灶转阴。2个月随访时,患者3血清蛋白电泳和游离抗体轻链浓度恢复正常,患者4指标进一步降低。
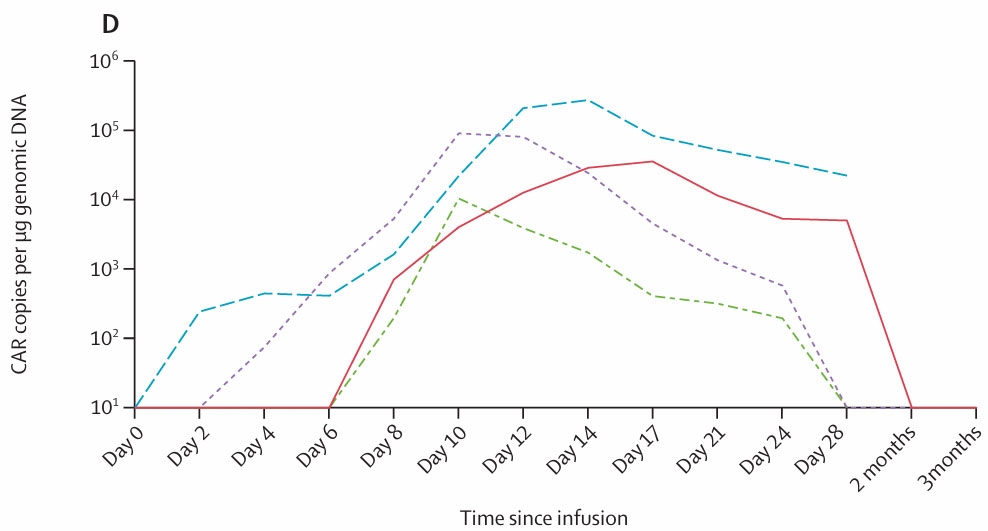
• 外周血CAR-T细胞于第4-8天首次检出,第10-17天达峰,并在骨髓、肿瘤组织、胸腔积液及脑脊液中均有检出(图D)。
• 输注后细胞亚群:患者2第10天CD38+CD138+BCMA+肿瘤细胞显著减少,同时肿瘤微环境中CD3+T细胞浸润明显。患者1的中央记忆型CAR+T细胞比例较高,患者2和4则以初始及中央记忆T细胞为主,患者3效应性及CD28-CD57+衰老T细胞富集。CD3-淋巴细胞和自然杀伤细胞中CAR表达量低。
结论:
该研究中ESO-T01显示出清除髓外病灶的潜力,肿瘤部位CAR-T细胞浸润增强可能得益于:①病毒颗粒更小利于穿透肿瘤组织;②体内生成的CAR-T细胞具有更优的肿瘤归巢能力和微环境适应性。但需更大样本量和更长随访期评估体内CAR-T细胞的持久性及疗效,并需随机对照设计增强证据力度,且其机制也有待验证。











